
More in HEALTH
-


HEALTH
တုပ်ကွေးဗိုင်းရပ်စ်ကာကွယ်ဆေးများဖွဲ့စည်းမှုအပေါ်ကွန်ဖရင့်ကိုနှိပ်ပါ
https://www.youtube.com/watch?v=ocqbyb4noxoo [/ embed] တုပ်ကွေးဗိုင်းရပ်စ်များသည်အဆက်မပြတ်တဖြည်းဖြည်းတိုးတက်လာပြီးထိရောက်မှုကိုထိန်းသိမ်းရန်ပုံမှန်ကာကွယ်ဆေးအသစ်များလိုအပ်သည်။ တစ်နှစ်လျှင်နှစ်ကြိမ်ကျွမ်းကျင်သူများကိုကမ္ဘာလုံးဆိုင်ရာစောင့်ကြည့်ရေးအချက်အလက်များကိုဆန်းစစ်ရန်နှင့်လာမည့်တုပ်ကွေးရောဂါအတွက်ကာကွယ်ဆေးရေးရာဖွဲ့စည်းမှုကိုထောက်ခံသူများကိုအတူတကွစုစည်းရန်ကြိုးစားသည်။ လာမည့်မြောက်ဘက်ခြမ်းတုပ်ကွေးရောဂါရာသီအတွက်အကြံပြုထားသောကာကွယ်ဆေးဖွဲ့စည်းမှုကိုကြေငြာခြင်းနှင့် ပတ်သက်. ကျွန်ုပ်တို့၏သတင်းစာရှင်းလင်းပွဲတွင်ဆက်သွယ်ပါ။
-
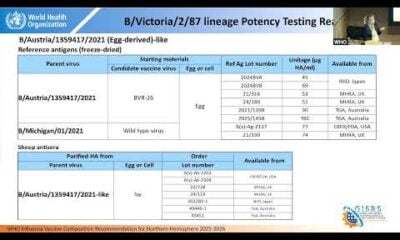

HEALTH
Live: မြောက်ပိုင်း hemisphere တုပ်ကွေးကာကွယ်ဆေးဖွဲ့စည်းမှုကို 2025-26 တွင်မည်သူတွေ့ဆုံမည်နည်း
https://www.youtube.com/watch?v=kgtmlmlmible [/ embed] 2025-2026 မြောက်ပိုင်း hemisphere တုပ်ကွေးရာသီတွင်အသုံးပြုမှုအတွက်တုပ်ကွေးဗိုင်းရပ်စ်ကာကွယ်ဆေးထိုးခြင်းဆိုင်ရာသတင်းအချက်အလက်များကိုမည်သူမှတ်ပုံတင်ခြင်းဆိုင်ရာတွေ့ဆုံဆွေးနွေးရေး
-


HEALTH
snoring vs
https://www.youtube.com/watch?v=Aqae4wj9fG [/ embed] Sole Selet Agnea: သင်လျစ်လျူရှုသင့်သည့်ဆိုင်းဘုတ်များ။ #Gundrymd #sleepapnea #sleep #sleep
-


HEALTH
Zen ဘုန်းတော်ကြီး၏ဘဝနှေးကွေးခြင်းနှင့်ဘဝကိုပျော်မွေ့ရန်လမ်းညွှန်
https://www.youtube.com/watch?v=MYWU98-U03c [/ embed] 💬 “သင်၌ရှိနေပြီးနှင့် ပတ်သက်. သင်နှင့်အတူနှေးကွေး။ အမှန်တကယ်တန်ဖိုးထားသောအခါ၎င်းသည်စစ်မှန်သောပျော်ရွှင်မှုလမ်းကြောင်းဖြစ်သည်။ ~ Haemin Sunim ⚡️ Haemin Sunim သည်ဇင်ဗုဒ္ဓဘာသာဘုန်းတော်ကြီးဖြစ်ပြီးစာအုပ်သုံးအုပ်၏စာရေးဆရာတစ် ဦး...
-


HEALTH
Webinar – Covid 19 နှင့်တုပ်ကွေးအတွက်ဗိုင်းရပ်စ်နှိမ်နင်းရေးကုသမှု, သူတို့ဘယ်လိုအလုပ်လုပ်သလဲ,
https://www.youtube.com/watch?v=SZSDSPQGXGI [/ embed] ဤဝဘ်ဆိုက်တွင် Covid 19 အတွက်မည်သည့်ဗိုင်းရပ်စ်နှိမ်နင်းရေးဆိုင်ရာကုသမှုများနှင့်သူတို့တုပ်ကွေးနှင့်သူတို့မည်သို့အလုပ်လုပ်သည်ကိုကျွမ်းကျင်သူများကနေနားထောင်ပါ။ နောက်ထပ်အချက်အလက်များကို http://agingsarch.com တွင်ရှာပါ






